Configuracion Electronica 1s2 2s2 2p6 3s2 3p5

La configuración electrónica describe cómo los electrones se distribuyen en los diferentes niveles y subniveles de energía alrededor del núcleo de un átomo. Entender esto nos permite predecir el comportamiento químico de un elemento. La configuración 1s2 2s2 2p6 3s2 3p5, en particular, nos revela la identidad de un átomo específico y su tendencia a reaccionar con otros.
¿Cómo llegamos a 1s2 2s2 2p6 3s2 3p5?
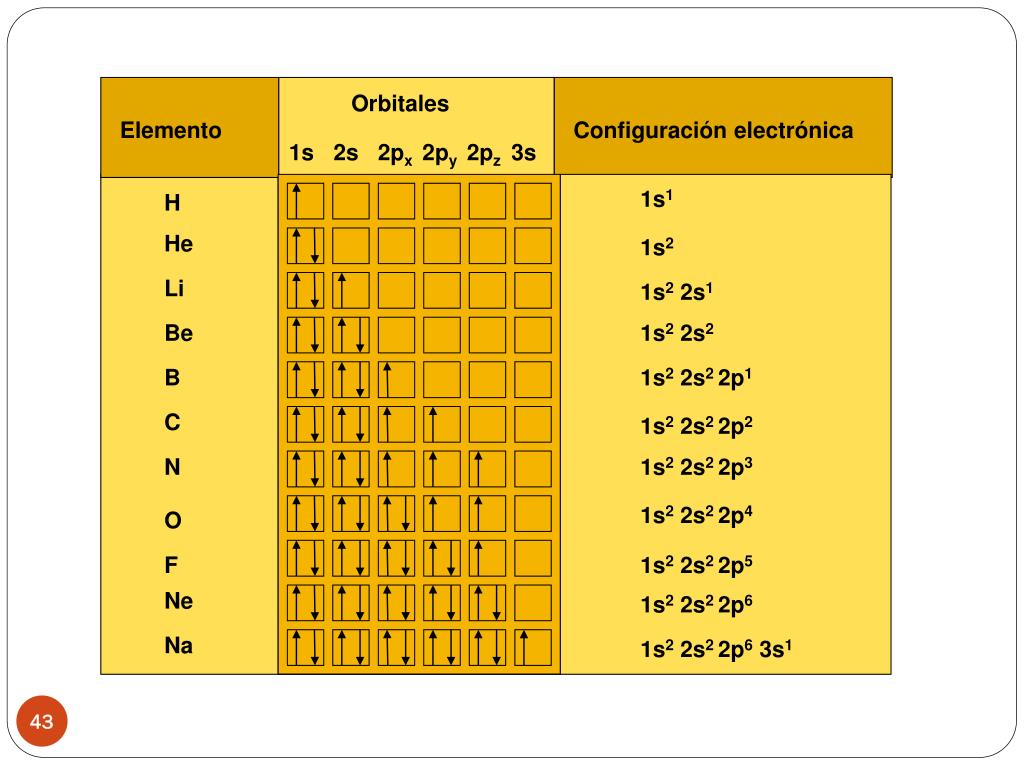
La configuración electrónica se construye paso a paso, llenando los orbitales en orden de energía creciente. Piensa en ello como llenar vasos con agua, empezando por los más bajos hasta los más altos. Aquí te mostramos cómo se hace:
- Principio de Aufbau: Los electrones primero llenan los orbitales de menor energía. El orden general es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p...
- Regla de Hund: Dentro de un subnivel (como el subnivel p, que tiene tres orbitales), los electrones se distribuyen individualmente en cada orbital antes de que cualquier orbital se llene con dos electrones. Esto maximiza el espín total.
- Principio de Exclusión de Pauli: Cada orbital atómico puede contener como máximo dos electrones, cada uno con espín opuesto.
Desglosando 1s2 2s2 2p6 3s2 3p5
Veamos cada parte de la configuración:
- 1s2: El nivel de energía 1 tiene su subnivel s lleno con 2 electrones.
- 2s2: El nivel de energía 2 tiene su subnivel s lleno con 2 electrones.
- 2p6: El nivel de energía 2 tiene su subnivel p lleno con 6 electrones (2 electrones en cada uno de los tres orbitales p).
- 3s2: El nivel de energía 3 tiene su subnivel s lleno con 2 electrones.
- 3p5: El nivel de energía 3 tiene su subnivel p con 5 electrones. Le falta un electrón para completar el subnivel p.
Sumando los superíndices (los números pequeños que indican el número de electrones en cada subnivel): 2 + 2 + 6 + 2 + 5 = 17. Por lo tanto, esta configuración electrónica pertenece al elemento con 17 protones: el cloro (Cl). El cloro es un halógeno y tiene una alta afinidad electrónica, lo que significa que tiende a ganar un electrón para completar su capa de valencia, formando un ion Cl-.