Escalas Y Representación Unidad De Medida Mol
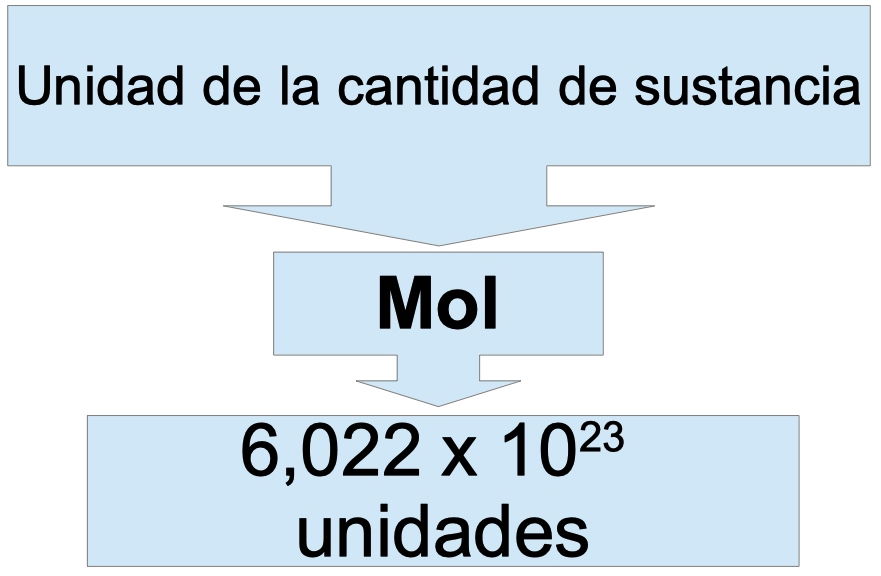
El mol es una unidad fundamental en química. ¿Qué mide? La cantidad de sustancia. No es un peso, ni un volumen, sino un número de partículas.
¿Qué significa "cantidad de sustancia"?
Imagínate que tienes bolsas de canicas y de pelotas de tenis. Quieres tener la misma "cantidad" de ambas cosas. Si cada canica pesa mucho menos que una pelota de tenis, necesitarás muchas más canicas para "compensar" y tener una cantidad "comparable". El mol hace algo similar para átomos y moléculas.
La cantidad de sustancia se refiere al número de entidades elementales (átomos, moléculas, iones, etc.) presentes en una muestra. El mol te dice cuántas de esas entidades tienes.
El Número de Avogadro
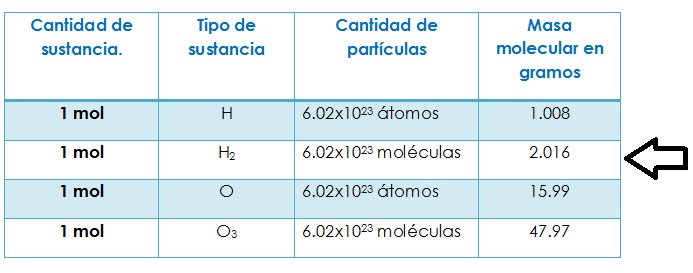
Un mol contiene un número específico de partículas: 6.022 x 1023. Este número se llama Número de Avogadro. Es un número enorme! Piensa en 602,200,000,000,000,000,000,000 cosas.
Si tuvieras un mol de granos de arroz, ¡cubrirían toda la superficie terrestre con una capa de varios kilómetros de espesor!
¿Por qué es importante el mol?
Los átomos y las moléculas son increíblemente pequeños. Trabajar con cantidades individuales sería impráctico. El mol nos da una unidad manejable. Permite relacionar la masa de una sustancia (que podemos medir fácilmente en un laboratorio) con el número de átomos o moléculas presentes.
Por ejemplo, la masa atómica del carbono es aproximadamente 12 unidades de masa atómica (uma). Un mol de átomos de carbono pesa aproximadamente 12 gramos. Esa es la conexión crucial: la masa atómica expresada en gramos es la masa de un mol de ese elemento.
Masa Molar
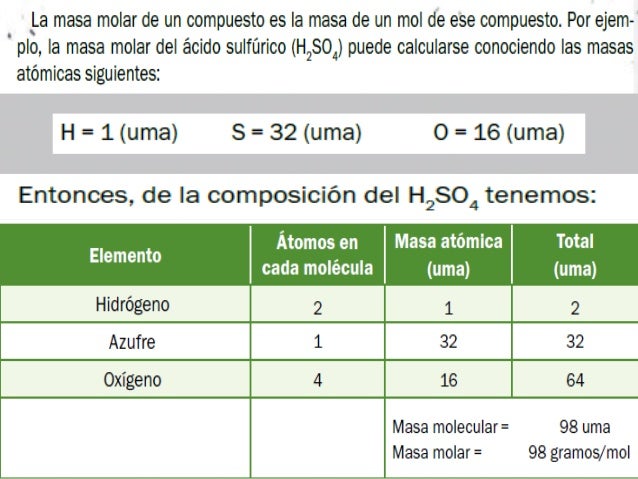
La masa molar es la masa de un mol de una sustancia. Se expresa en gramos por mol (g/mol). Para encontrar la masa molar de un compuesto, sumas las masas atómicas de todos los átomos en la fórmula del compuesto.
Por ejemplo, el agua (H2O) tiene dos átomos de hidrógeno (cada uno con una masa atómica aproximada de 1 uma) y un átomo de oxígeno (con una masa atómica aproximada de 16 uma). La masa molar del agua es entonces (2 x 1) + 16 = 18 g/mol. Esto significa que un mol de agua pesa 18 gramos.
Usando el Mol en Cálculos
El mol es esencial para realizar cálculos estequiométricos, es decir, para determinar las cantidades relativas de reactivos y productos en una reacción química.
Si sabes cuántos moles de un reactivo tienes, puedes calcular cuántos moles de producto se formarán. Esto es fundamental para planificar experimentos y obtener los resultados deseados en química.
En resumen, el mol es un puente entre el mundo microscópico de los átomos y las moléculas y el mundo macroscópico que podemos medir y manipular en el laboratorio.