Factores Que Afectan La Velocidad De Reaccion

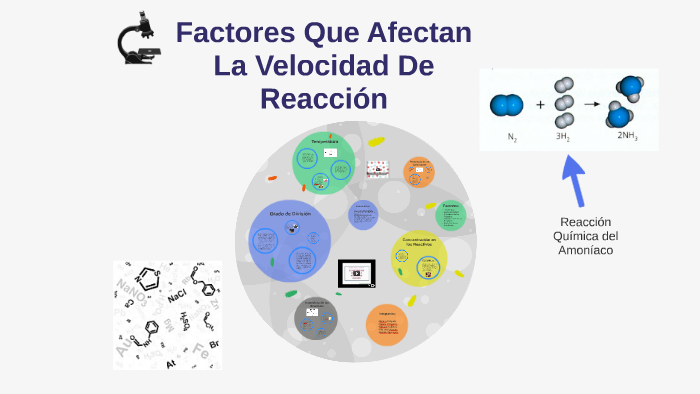
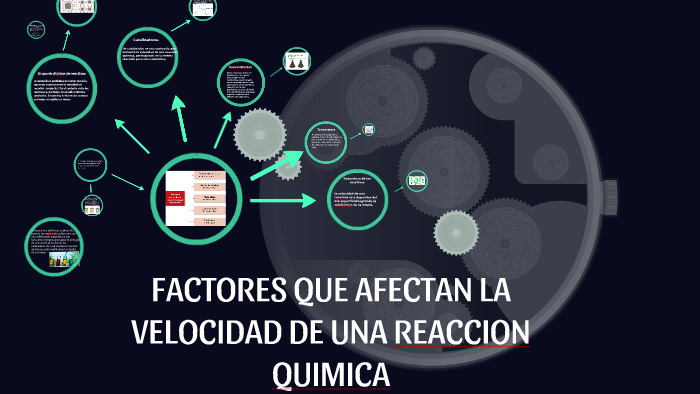
La velocidad de reacción se refiere a la rapidez con la que los reactivos se transforman en productos en una reacción química. Varios factores pueden influir significativamente en esta velocidad, acelerándola o ralentizándola.
Uno de los factores más importantes es la concentración de los reactivos. Generalmente, a mayor concentración de los reactivos, mayor es la velocidad de reacción. Esto se debe a que hay más moléculas disponibles para colisionar y reaccionar entre sí. Por ejemplo, la combustión de un trozo de madera arde más rápido en una atmósfera de oxígeno puro que en el aire, que solo contiene aproximadamente un 21% de oxígeno.
La temperatura también juega un papel crucial. A medida que aumenta la temperatura, las moléculas se mueven más rápido y con mayor energía cinética. Esto incrementa la frecuencia y la fuerza de las colisiones, lo que a su vez aumenta la velocidad de reacción. Un ejemplo simple es cocinar alimentos: a mayor temperatura, más rápido se cocinan.
La presencia de un catalizador puede acelerar una reacción química sin consumirse en el proceso. Los catalizadores proporcionan una vía de reacción alternativa con una energía de activación más baja, lo que facilita la formación de productos. Por ejemplo, el platino se utiliza como catalizador en los convertidores catalíticos de los automóviles para acelerar la conversión de gases contaminantes en gases menos dañinos.
El estado físico de los reactivos también es importante. Las reacciones son más rápidas cuando los reactivos se encuentran en el mismo estado físico (homogéneas), ya que las moléculas pueden mezclarse y colisionar más fácilmente. Por ejemplo, una reacción entre dos líquidos suele ser más rápida que una reacción entre un sólido y un líquido.
Finalmente, el área de superficie de un reactivo sólido afecta la velocidad de reacción. Cuanto mayor sea el área de superficie, mayor será la velocidad de reacción. Esto se debe a que hay más puntos de contacto disponibles para la reacción. Por ejemplo, un trozo de madera finamente picado arderá más rápido que un tronco grande.
En resumen, la velocidad de una reacción química se ve afectada por la concentración de los reactivos, la temperatura, la presencia de catalizadores, el estado físico de los reactivos y el área de superficie (en el caso de sólidos). Comprender estos factores es fundamental para controlar y optimizar las reacciones químicas en diversas aplicaciones.
El conocimiento de estos factores tiene aplicaciones amplias, desde la industria química (optimización de procesos de producción) hasta la cocina (acelerar o ralentizar la cocción de alimentos) y la medicina (diseño de fármacos con tasas de reacción específicas en el cuerpo).