La Estructura De La Materia Y Sus Propiedades

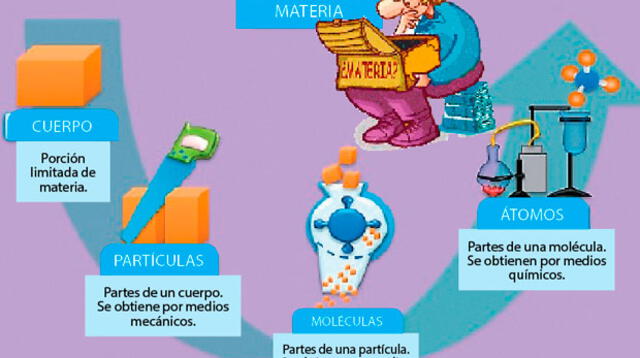
La estructura de la materia se refiere a la forma en que los átomos y las moléculas se organizan e interactúan para formar todo lo que vemos y tocamos. Comprenderla es clave para predecir y manipular las propiedades de los materiales, lo que tiene aplicaciones directas en la creación de nuevos materiales, la mejora de procesos industriales y la resolución de problemas cotidianos.
Entendiendo la Estructura paso a paso:
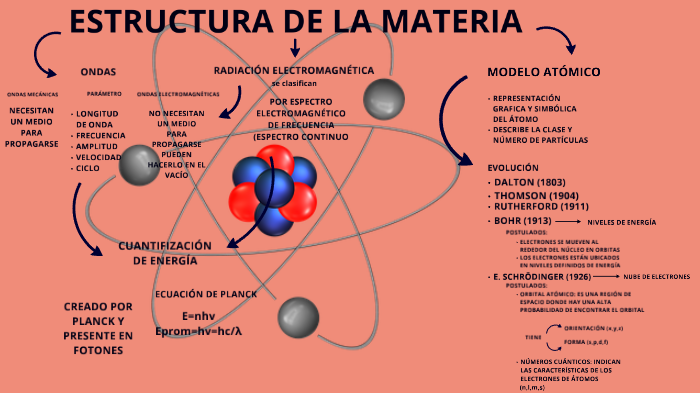
- Nivel Atómico: Todo empieza con los átomos. Cada átomo tiene un núcleo con protones (carga positiva) y neutrones (sin carga), rodeado de electrones (carga negativa). El número de protones define el elemento (e.g., 6 protones = carbono).
- Enlace Atómico: Los átomos se combinan mediante enlaces para formar moléculas o redes. Hay varios tipos de enlaces:
- Enlaces iónicos: Transferencia de electrones (e.g., sal de mesa - NaCl). Son fuertes y dan lugar a altos puntos de fusión.
- Enlaces covalentes: Comparten electrones (e.g., agua - H₂O). La polaridad del enlace afecta las propiedades del material.
- Enlaces metálicos: "Mar" de electrones que permiten la conducción eléctrica (e.g., cobre).
- Estructura Molecular: La forma en que las moléculas se organizan influye en las propiedades macroscópicas.
- Cristalina: Ordenamiento regular y repetitivo (e.g., diamante). Suelen ser duras y con puntos de fusión definidos.
- Amorfa: Desorden aleatorio (e.g., vidrio). Son más maleables y tienen un rango de fusión.
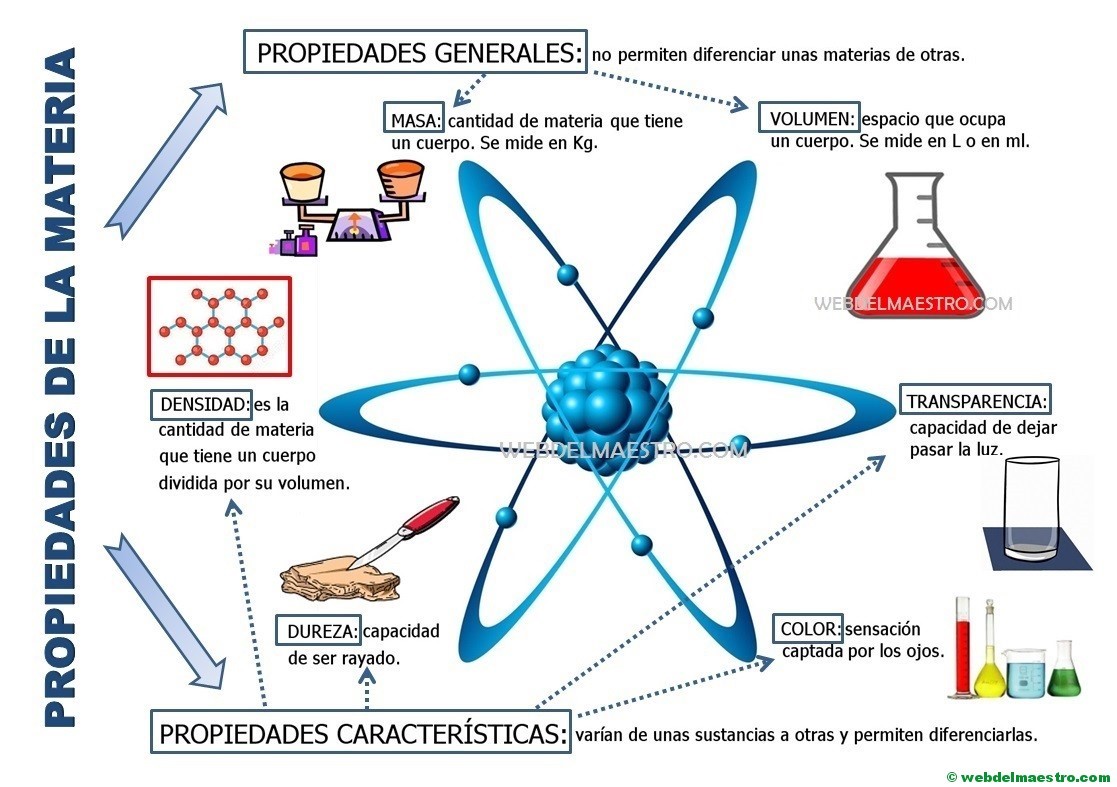
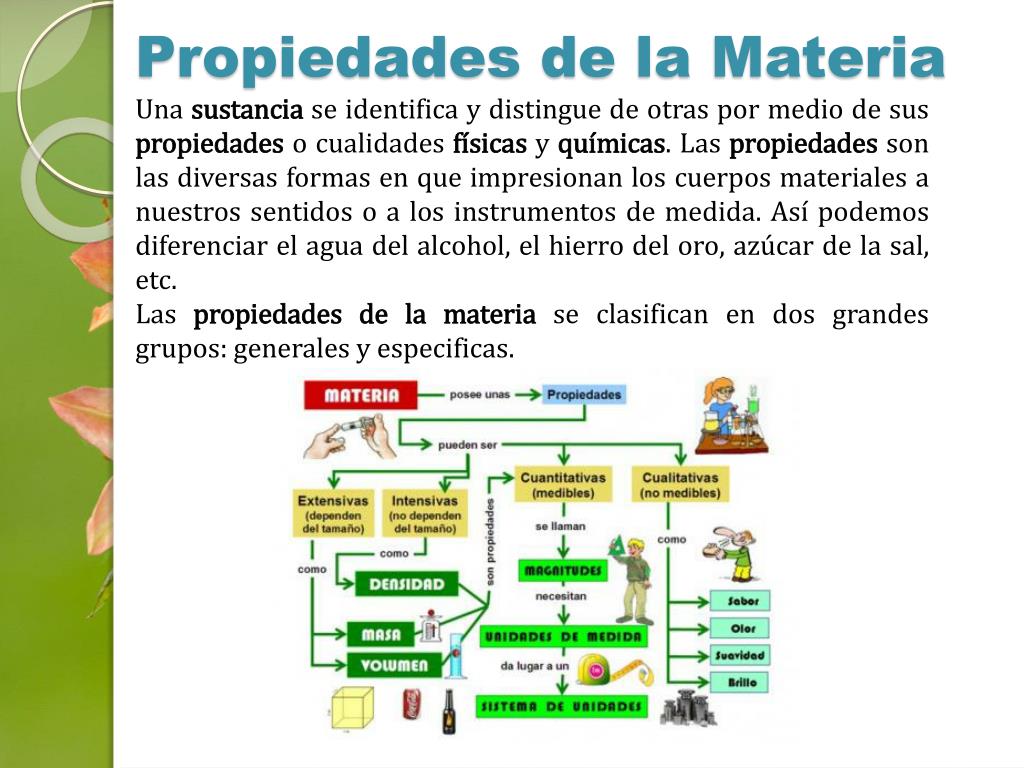
- Propiedades Macroscópicas: La estructura interna afecta las propiedades que podemos observar:
- Dureza: Resistencia a la deformación (diamante vs. plastilina).
- Conductividad: Capacidad de conducir electricidad o calor (cobre vs. madera).
- Punto de Fusión: Temperatura a la que un sólido se convierte en líquido (hielo vs. hierro).
Ejemplo Práctico: ¿Por qué el hierro se oxida (se corroe) y el oro no? Porque la estructura atómica del hierro facilita su reacción con el oxígeno del aire, formando óxido de hierro (herrumbre). El oro, por su configuración electrónica más estable, es menos reactivo y no se oxida fácilmente.
Con este conocimiento básico, puedes empezar a comprender por qué los materiales se comportan de la manera en que lo hacen y cómo manipularlos para obtener las propiedades deseadas.