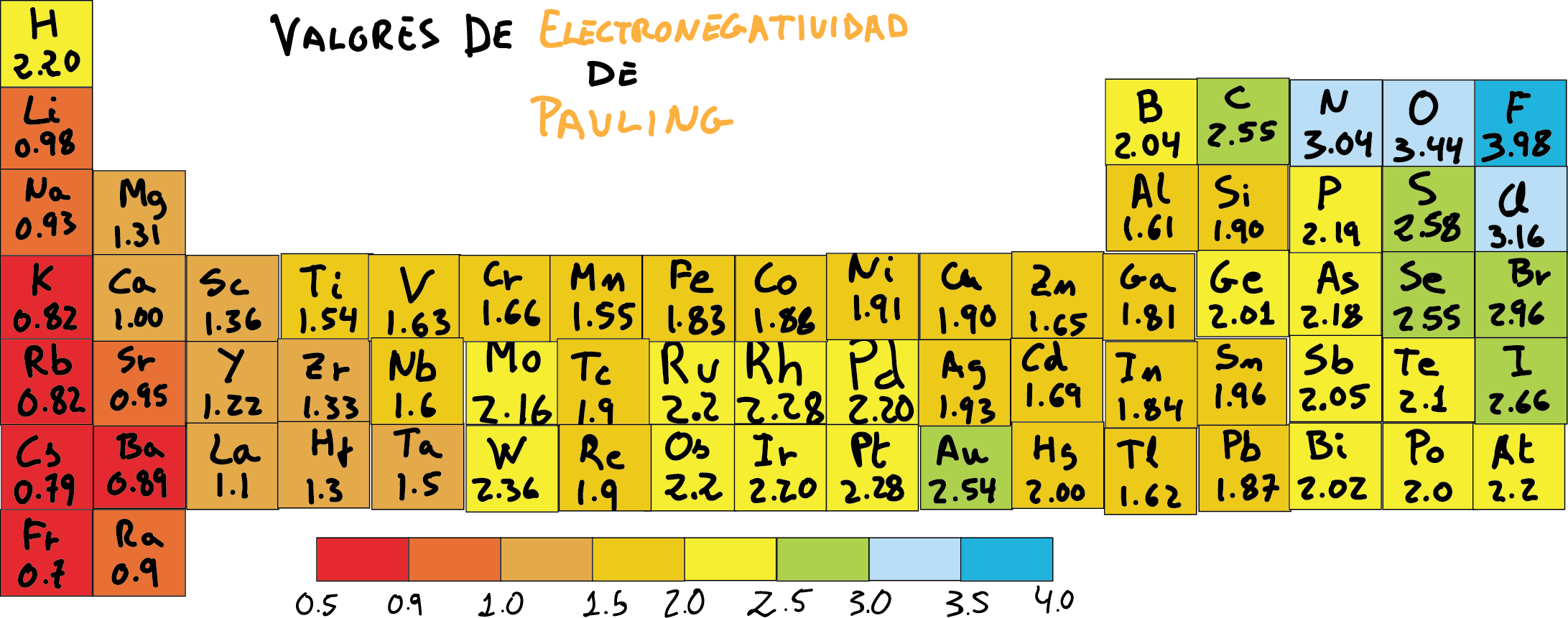
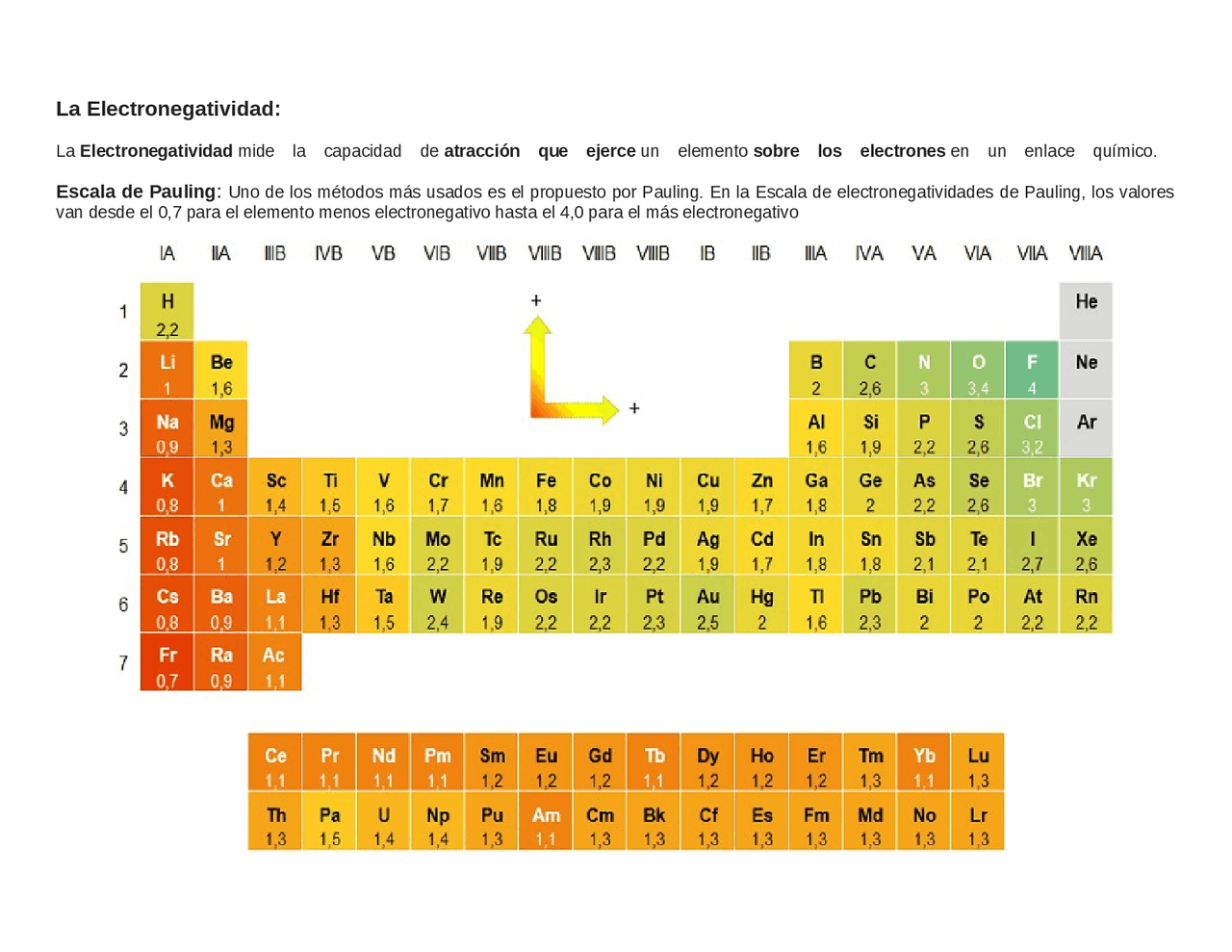
Tabla De Electronegatividad Escala De Pauling
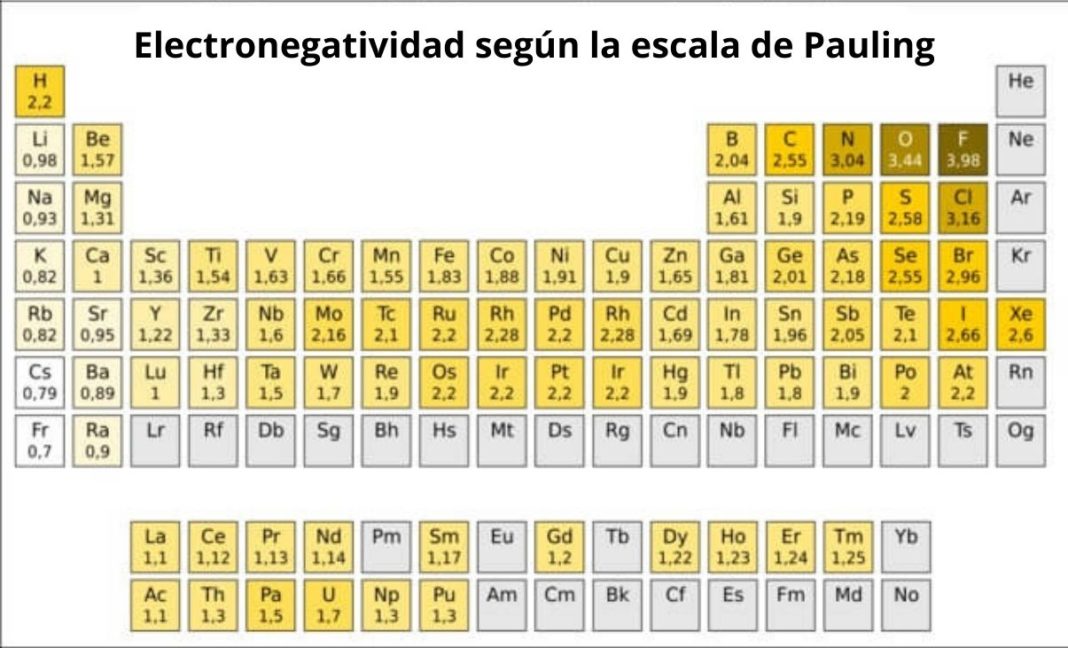
La tabla de electronegatividad de Pauling es una herramienta que nos dice cuán fuerte un átomo atrae electrones hacia sí mismo en un enlace químico. En otras palabras, mide la "sed" de un átomo por electrones.
¿Qué significa electronegatividad?
La electronegatividad es la capacidad de un átomo para atraer electrones en un enlace. Imagina dos personas tirando de una cuerda. La persona más fuerte (más electronegativa) atraerá la cuerda hacia su lado. En un enlace químico, en lugar de personas, tenemos átomos y, en lugar de una cuerda, tenemos electrones.
La escala de Pauling: Números que importan
Linus Pauling, un famoso químico, creó esta escala. Asignó un número a cada elemento, desde el menos electronegativo (al que le gustan poco los electrones) hasta el más electronegativo (al que le encantan los electrones). Estos números generalmente varían de 0.7 a 4.0.
El flúor (F) es el elemento más electronegativo, con un valor de 4.0. Esto significa que tiene la mayor "sed" de electrones. El francio (Fr) es uno de los menos electronegativos, con un valor cercano a 0.7. No le importa mucho tener electrones cerca.
¿Cómo usar la tabla de electronegatividad?
La tabla te ayuda a predecir el tipo de enlace que se formará entre dos átomos. Si la diferencia de electronegatividad entre dos átomos es:
- Baja (menor que 0.4): Se forma un enlace covalente no polar. Los electrones se comparten casi por igual. Por ejemplo, el enlace entre dos átomos de hidrógeno (H₂).
- Media (entre 0.4 y 1.7): Se forma un enlace covalente polar. Los electrones se comparten, pero un átomo los atrae con más fuerza que el otro. Por ejemplo, el enlace en el agua (H₂O). El oxígeno es más electronegativo que el hidrógeno, por lo que atrae los electrones con más fuerza, creando una carga parcial negativa en el oxígeno y cargas parciales positivas en los hidrógenos.
- Alta (mayor que 1.7): Se forma un enlace iónico. Un átomo roba completamente los electrones al otro. Por ejemplo, el enlace en la sal de mesa (NaCl). El cloro es mucho más electronegativo que el sodio, por lo que le roba un electrón, formando iones Na⁺ y Cl⁻.
Ejemplos sencillos
Imagina una pareja compartiendo una pizza. Si ambos tienen la misma hambre (electronegatividad), la pizza se divide por igual (enlace covalente no polar). Si uno tiene mucha más hambre que el otro, se queda con la mayor parte de la pizza (enlace covalente polar). Si uno le quita toda la pizza al otro, se la roba (enlace iónico).
Importancia de la electronegatividad
La electronegatividad es crucial para entender las propiedades de las moléculas. Influye en la polaridad de los enlaces, la forma de las moléculas y, por lo tanto, sus propiedades físicas y químicas, como el punto de ebullición, la solubilidad y la reactividad.
En resumen, la tabla de electronegatividad de Pauling es una herramienta poderosa que nos ayuda a comprender cómo los átomos interactúan entre sí para formar moléculas y cómo estas interacciones determinan el comportamiento de la materia.

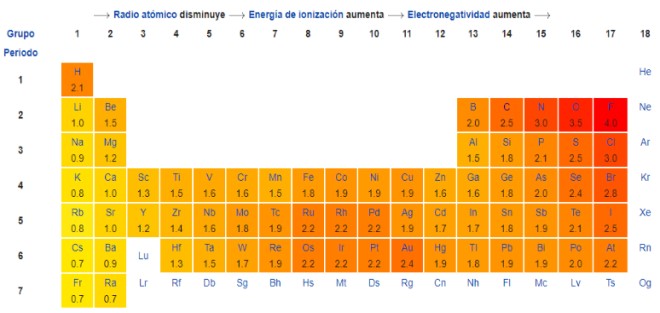
.PNG)